产品概述
本产品是一种化学成分明确、无人和动物血清、无任何动物成分的培养基,适用于人外周血、脐带血、骨髓等来源CIK细胞的培养扩增。产品中所有蛋白质成分均为重组技术获得,包括重组人白蛋白、重组人转铁蛋白等多种成分。产品不含任何抗生素。
激活剂,为特异性活化CIK细胞而设计。激活剂中含有特殊的活性物质,鲎试剂法测定热源两者均为阳性(≥0.5U/ml)。然而,在培养过程中,该成分不会存在于细胞终产品中,因此,细胞产品热源测定应为阴性。
使用该套装,培养起始细胞可以为外周血、胎盘/脐带血或骨髓单个核细胞。一般而言,使用该套装培养14天,细胞总数扩增100倍以上,CD3+/CD56+细胞比例超过30%,CD56+细胞可达到50%以上。
激活剂4°C储存,有效期6个月。CIK细胞优势扩增培养基均4°C储存,有效期12个月。重组人IL-15应于 4°C储存,保质期24个月。
所有成分均应避光保存,不宜剧烈震荡,以免大分子物质因变性而失活。
技术指标
(一) CIK优势扩增培养基
1. 浅红色,透明,pH7.1-7.4
2. 细菌培养(阴性)
3. 真菌培养(阴性)
4. 热源(鲎试剂法)≤0.25U/ml
5. NK92细胞生长:良好
(二) 激活剂
1. 浅白色,半透明
2. 细菌培养(阴性)
3. 真菌培养(阴性)
(三)重组人IL-15
1.白色粉末
2.细菌培养(阴性)
3.真菌培养(阴性)
产品规格
产品货号 | 名称 | 规格 | 储存条件 | 运输条件 |
1003A | CIK激活剂 | 1ml | 4°C | 冰袋 |
1008 | 重组人IL-15 | 100ug | 4°C | 冰袋 |
1003 | 人CIK优势扩增培养基 | 1000ml×2 | 4°C | 冰袋 |
淘宝购买请复制以下链接
https://item.taobao.com/item.htm?spm=a1z10.1-c.w4004-703525244.6.7654559eBOWjXw&id=647974320639
产品优势
1. 本产品是一种化学成分明确、无人和动物血清、无任何动物成分的培养基,以保障产品的安全性。
2. 适用于人外周血、脐带血、骨髓等来源CINK细胞的培养扩增。
3. 产品中所有蛋白质成分均为重组技术获得,包括重组人白蛋白、重组人转铁蛋白等多种成分。
4. 培养基质检标准,严格按照上海细胞治疗协会规定的《人临床试验用培养基的标准》执行。
5. 使用该套装,培养起始细胞可以为外周血、胎盘/脐带血或骨髓单个核细胞。一般而言,使用该套装培养14天,细胞总数扩增100倍以上, CD3+/CD56+细胞(CIK细胞)比例超过30%, CD56+细胞比例超过70%。
6. 该培养基为本公司专利技术,在培养CIK的同时,尽可能扩增NK细胞,从而使终产品中的杀伤细胞比例显著提升,以期获得更好的治疗效果。
7. 已完成I类医疗器械备案,备案号为闽泉械备20210017。
应用举例
采取健康人抗凝无菌血30ml,按照Clin-SFM®-CIK操作手册收集单个核细胞培养。共获得单个核细胞5*10^7个,将细胞悬浮于15ml扩增培养基中,按照操作手册进行培养。2周后收集细胞,细胞总数达6.7*10^9个,流式细胞学分析,CIK细胞达到30%以上, CD56+细胞达到70%以上。如图所示。
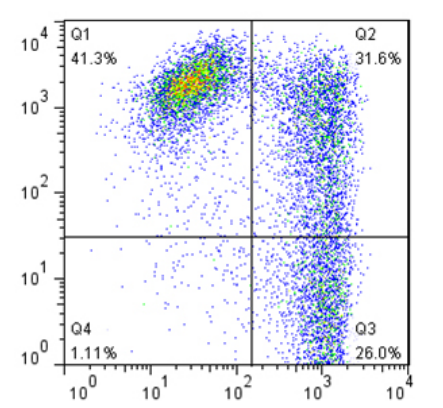
附图-细胞FCM分析结果(横坐标:CD3-FITC;纵坐标:CD56-PE)
产品概述
本产品是一种化学成分明确、无人和动物血清、无任何动物成分的培养基,适用于人外周血、脐带血、骨髓等来源CIK细胞的培养扩增。产品中所有蛋白质成分均为重组技术获得,包括重组人白蛋白、重组人转铁蛋白等多种成分。产品不含任何抗生素。
激活剂为特异性活化CIK细胞而设计。激活剂中含有特殊的活性物质,鲎试剂法测定热源两者均为阳性(≥0.5U/ml)。然而,在培养过程中,该成分不会存在于细胞终产品中,因此,细胞产品热源测定应为阴性。
使用该套装,培养起始细胞可以为外周血、胎盘/脐带血或骨髓单个核细胞。一般而言,使用该套装培养14天,细胞总数扩增100倍以上,CD3+/CD56+细胞比例超过30%,CD56+细胞可达到50%以上。
激活剂4°C储存,有效期6个月。辅助激活剂及CIK细胞筛选扩增培养基均4°C储存,有效期12个月。
所有成分均应避光保存,不宜剧烈震荡,以免大分子物质因变性而失活。
技术指标
(一) 激活剂
1. 浅白色,半透明
2. 细菌培养(阴性)
3. 真菌培养(阴性)
(二) CIK优势扩增培养基
1. 浅红色,透明,pH7.1-7.4
2. 细菌培养(阴性)
3. 真菌培养(阴性)
4. 热源(鲎试剂法)≤0.25U/ml
5. NK92细胞生长:良好
产品规格
产品货号 | 名称 | 规格 | 储存条件 | 运输条件 |
1003A | 激活剂 | 1ml | 4°C | 冰袋 |
1008 | IL-15 | 100ug | 4°C | 冰袋 |
1003C | CIK优势扩增液 | 1000ml×2 | 4°C | 冰袋 |
【操作方法】
本操作方法以采集外周血30ml为例,介绍CIK细胞诱导扩增培养的具体方法。请仔细阅读操作手册,尤其注意每个提醒事项。
1. 培养瓶铺板
(1) 可使用Corning公司生产、适于贴壁细胞培养的培养瓶。如货号为431082,底面积为225 cm2的培养瓶。
(2) 将辅助激活剂(30 ml)和激活剂(1 ml)置于37 °C复温10 min,轻轻混匀。按照下表提供的体积,将激活剂和辅助激活剂加入培养瓶中。将其置于37 °C,静置1h后可使用。也可置于4°C,过夜即可使用,或封闭培养瓶,可储存2周。
培养瓶(底面积) | 25 cm2 | 75 cm2 | 175 cm2 | 225 cm2 |
生理盐水体积 | 5 ml | 10 ml | 20 ml | 30 ml |
激活剂体积 | 500 μl | 1000μl | 1500 μl | 2000 μl |
2. 单个核细胞分离、血浆采集及处理
1) 开启水浴箱,调整温度至56 °C,以备灭活补体用。
2) 常规无菌采集抗凝外周血,肝素抗凝。
3) 分离单个核细胞前,将已经预铺板的培养瓶放置37 °C。
4) 常规密度梯度离心法,离心(800 g,25-30 min),收集单个核细胞。建议离心机处于brake-off状态。
5) 吸取上层血浆,56 °C,30 min灭活补体,之后立即置于-20 °C静置2 min,离心(3000 g,至少15-30 min)以去除血小板。
6) 收取单个核细胞层,生理盐水充分混匀。离心洗涤(500 g,15 min)。
注意:吸取单个核细胞层时,吸取过多的上层血浆部分,会导致血小板混杂于单个核细胞群中;吸取过多的Ficoll-Hypaque,会导致粒细胞混杂于单个核细胞中;在洗涤用的生理盐水中,如加入0.38%枸橼酸钠,可减轻血小板的混杂现象。
7) 生理盐水悬浮细胞沉淀,再次离心洗涤(500 g,8-10 min)。
8) 使用CIK细胞扩增培养基悬浮细胞。
取10 ul细胞悬液,加入白细胞稀释液(或3%冰醋酸)90 ul,混匀后计细胞数。将细胞浓度调整为3×106/ml。
3. 细胞培养
1) 取出已经预铺板且置于37 °C孵育的培养瓶,吸净稀释的激活剂。沿培养瓶侧壁加入少量生理盐水,轻轻混匀后吸除。
2) 根据细胞计数结果,将细胞终浓度调整为3×106/ml。单个核细胞悬液中加入IFN-gamma(2000U/ml),自体血浆浓度为2.5-5%。
注:如使用冻存复苏的单个核细胞,建议细胞浓度为5×106/ml。同样的,如使用脐血单个核细胞作为培养起始细胞,建议细胞浓度为5×106/ml.
细胞浓度以及接种培养瓶的表面积,是决定最终培养CIK细胞比例的两个关键因素。我们推荐细胞密度在3×106/ml左右。同时,根据接种细胞体积选择适宜底面积的培养瓶。下表可作为参考。
培养瓶(底面积) | 25cm2 | 75cm2 | 175cm2 | 225cm2 |
细胞悬液总体积 | 2.5-5ml | 7.5-10ml | 15-20ml | 25-30ml |
细胞总数 | 0.75-1.5×107 | 2-3×107 | 4.5-6×107 | 7.5-9×107 |
3) 将细胞悬液加入已经预铺板的培养瓶中,置于37 °C、5%CO2、饱和湿度的细胞培养箱中静置培养。
4) 培养24小时后,加入重组人IL-2(1000 U/ml)和CIK辅助激活剂(1 μg/ml)。CIK辅助激活剂可以用抗人CD3单克隆抗体替代,使用浓度为(1 μg/ml)。
5) 继续培养。培养液变黄后补充新鲜培养基,新鲜培养基含血浆(2.5-5%)和重组人IL-15(50ng/ml)。补液量一般为补液前原体积的1倍。也可根据细胞悬液和细胞浓度,补充原体积的0.5倍。一般而言,细胞应在预铺板的培养瓶中培养至少一周。Corning生产的225 cm2培养瓶,最大体积可达400 ml。
6) 当原瓶培养基变黄、总体积接近或达到培养瓶最大体积时,补充新鲜的培养基,并分瓶培养。分瓶时,一定将贴壁的细胞转移至新的培养瓶。可以将细胞悬液转移后,再旧培养瓶中加入冷的生理盐水,静置于室温5分钟。之后,轻轻拍打培养瓶侧壁,吹打后转移至离心管收集细胞,平均分配于新的培养瓶中.
7) 补充新鲜培养基,含2.5-5%血浆和IL-15。
8) 每天观察细胞集落大小及细胞密度,及时补充含血浆和IL-15的新鲜培养基,新鲜培养基总量与原来体积相同(等量补液)或为原体积的0.5倍。每次补液前,轻轻拍打培养瓶侧壁,使贴壁的集落悬浮。
9) 主要根据培养基颜色,每天或每隔1-2天补充新鲜的含血浆及细胞因子的CIK细胞扩增培养基。必要时再次转用新的培养瓶扩增。培养12-15天,细胞数达到目的用量后,可进行质量检验,检测合格后收获细胞。
注:细胞培养9-10天后,为了提高扩增效率,可在使用IL-15的基础上,添加IL-2(浓度为500IU/ml).
4. 细胞收获
1) 将细胞转移至500 ml离心管,计细胞数及细胞活力。
2) 离心收获细胞,500 g,15 min。
3) 将细胞转移至250 ml离心管,生理盐水悬浮,离心洗涤,500 g,15 min。
4) 将细胞转移至50 ml离心管,生理盐水悬浮,离心洗涤,500 g,10 min。
5) 用含1%注射用人白蛋白的生理盐水悬浮细胞。
6) 使用孔径为70 μm的细胞筛过滤细胞。
7) 留小样备质检。
8) 将细胞转移至输液袋中。静置于室温。
5. 注意事项
(1)CIK细胞来源于CD8阳性的细胞,在激活剂及IFN-gamma作用下,单核细胞分泌IL-12以促进CD8阳性细胞分化为CD3+/CD56+的细胞(CIK)。因此,在加入抗体和细胞因子之前,IFN-gamma作用时间不应低于24小时。
(2)细胞应尽可能在原培养瓶中培养,或尽可能延长在原培养瓶中的培养时间。这是决定CIK细胞培养是否成功的关键因素。因此,将单个核细胞在原培养瓶中培养超过1周,常可达到较好的效果。可见,补液时机要把握,液体变黄才补液。补液量要明确,原体积的一倍最适宜。
(3)自体血浆制备过程中去除血小板要彻底,过多的血小板会影响CIK细胞分化。自体血浆不够或不适宜培养时,应加用人AB混合血浆,冻融后离心(3000 g,15 min)去除血小板,并添加注射用肝素钠10 U/ml,以防形成凝胶。